ماذا يحدث عندما تمشط شعرك الجاف ثم تقرب المشط من بضع قطع صغيرة من الورق؟ سيؤدي تمشيط شعرك الجاف إلى نقل بعض الجسيمات دون الذرية التي تسمى الإلكترونات من الشعر إلى المشط. شحنة الإلكترون سالبة ، وبالتالي سيكتسب المشط أيضًا شحنة إلكترون (شحنة سالبة). أخيرًا، عندما يتم تقريب المشط من قطع الورق ، تنجذب قطع الورق إلى المشط.
وبالمثل ، ماذا يحدث عندما تقوم بفرك قطعة قماش حريرية على قضيب زجاجي ثم يتم وضع قضيب الزجاج بالقرب من بالون منتفخ؟ يتم نقل الإلكترونات من قضيب الزجاج إلى القماش الحريري. ومن ثم ، يصبح قضيب الزجاج مشحونًا بشكل إيجابي. عندما يتم إحضار قضيب الزجاج موجب الشحنة بالقرب من البالون المتضخم ، فإنه سينجذب إلى قضيب الزجاج.
تثبت هذه الأنشطة كائنين عند فركهما معًا ، تصبح الأشياء مشحونة كهربائيًا. ومع ذلك ، كيف تصبح الأجسام مشحونة كهربائيًا؟ تتكون كل المادة من جسيمات قابلة للقسمة تسمى الذرات. تتكون الذرات من جسيمات دون ذرية صغيرة مشحونة تسمى الإلكترونات والبروتونات والنيوترونات.
في وقت سابق افترض جون دالتون أن الذرات هي جزيئات غير قابلة للتجزئة. ومع ذلك ، فإن مساهمة العديد من العلماء بحلول نهاية القرن التاسع عشر أو بداية القرن العشرين بدأت تدريجيًا في الكشف عن أن الذرات قابلة للقسمة إلى جسيمات دون ذرية دقيقة.
تعرف المزيد حول التركيبب الذري والجزيئي
- النظائر
اكتشاف الجسيمات دون الذرية
اكتشاف وجود الإلكترون وشحنته
اقترح فيزيائي بريطاني يُدعى طومسون في عام 1897 أن الذرة تتكون من جسيم سالب الشحنة على الأقل. اكتشف الإلكترونات أثناء عمله في تجربة. حيث تم في التجربة تمرير الغاز عند ضغط منخفض عبر أنبوب زجاجي مفرغ.
تم وضع قطبين كهربائيين على الطرفين المتقابلين لأنبوب التفريغ الزجاجي والذي تم توصيله بمصدر جهد عالي (بطارية). كان يسمى القطب المتصل بالنهاية السالبة الكاثود وكان القطب المتصل بالنهاية الموجبة يسمى الأنود.
لاحظ طومسون تيارًا من الجسيمات سالبة الشحنة المنبعثة من الكاثود. علاوة على ذلك ، تحرك تيار الجسيمات نحو الأنود. تسمى تيارات الجسيمات سالبة الشحنة التي يتم تفريغها من نهاية الكاثود لأنبوب التفريغ أشعة الكاثود. أطلق عليها اسم "الجسيمات" التي سُميت فيما بعد "الإلكترون".
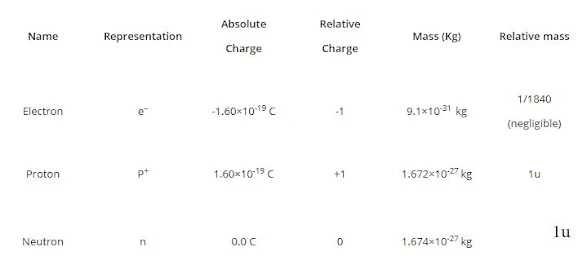
يمثل الإلكترون بالحرف "e" ومن المعروف أنه يساهم في الشحن السالب للذرة. الشحنة المطلقة للإلكترون هي الشحنة السالبة 1.6×10-19 كولوم. الكتلة النسبية للإلكترون هي 1/1836 (1/2000) ، وبالتالي فإن كتلة الإلكترون صغيرة جدًا وتعتبر 0. لذلك ، فإن كتلة الإلكترون لا تكاد تذكر وشحنة الإلكترون هي -1.
اكتشاف البروتون
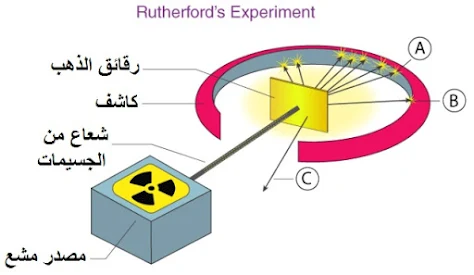
اكتشف رذرفورد البروتون عندما أجرى تجربة رقائق الذهب الشهيرة. في البداية ، اكتشف جولدشتاين في عام 1886 وجود أشعة موجبة الشحنة أثناء إجراء تجربة في الأنبوب المفرغ باستخدام الكاثود المثقوب. كانت التجربة مشابهة لـ طومسون ولكن مع مواقف مختلفة. أدى هذا إلى انبعاث الجسيمات المشحونة من الأنود.
تسمى الإشعاعات الموجبة الشحنة الناتجة من طرف الأنود لأنبوب التفريغ أشعة القناة. سميت الأشعة باسم أشعة الأنود أو أشعة القناة. أدت سلسلة من التجارب إلى اكتشاف البروتونات. تُعرف البروتونات بالجسيمات التي تساهم في الشحنة الموجبة للذرة.
تم العثور على كتلة من الجسيمات أكبر 2000 مرة من كتلة الإلكترون. تم تمثيل البروتونات بالحرف "p". الشحنة المطلقة للبروتون هي الشحنة الموجبة 1.6×10-19 كولوم. كتلة البروتون 1.6×10-24 g وتعتبر 1 (كتلة ذرة الهيدروجين). تعتبر كتلة البروتون وحدة واحدة وتعتبر شحنتها +1.
اكتشاف النيوترون
لم يتم اكتشاف النيوترون حتى عام 1932. اكتشفه جيمس تشادويك باستخدام جزيئات مبعثرة لحساب كتلة الجسيم المحايد. الجسيم دون الذري "نيوترون" موجود في نواة الذرة. يُمثل النيوترون بالحرف "n" ويعتبر جسيمًا متعادلًا. تُقاس كتلة النيوترون بـ 1.6×10-24 g.
الجرام ليس وحدة مناسبة جدًا لحساب مثل هذه الجسيمات دون الذرية الدقيقة. لذلك ، يتم حسابها بدلاً من ذلك في Dalton أو amu (وحدة الكتلة الذرية). النيوترون والبروتون لهما كتلة مماثلة تقارب 1 وحدة دولية.
ملخص الجسيمات دون الذرية:
نتيجة
أثار اكتشاف الجسيمات دون الذرية العديد من الأسئلة. كان أحدها كيفية ترتيب هذه الجسيمات دون الذرية في ذرة. أدى ذلك إلى اقتراح نماذج مختلفة من هذه الجسيمات المشحونة. تشكل هذه أساس الموضوع الواسع "لبنية الذرة".
حل الأسئلة بالنسبة لك
سؤال 1: أي من الخيارات يمثل خصائص الإلكترونات؟
الشحنة النسبية -1
كتلة لا تذكر
الشحنة معاكسة ومساوية البروتون
الكل مما سبق