ما هو تفاعل احتراق
تفاعل الاحتراق هو تفاعل كيميائي يخضع فيه الوقود للأكسدة عن طريق التفاعل مع عامل مؤكسد ، مما يؤدي إلى إطلاق الطاقة (عادة في شكل حرارة). تفاعلات الاحتراق هي بشكل عام تفاعلات أكسدة شديدة طاردة للحرارة بين مادة مؤكسدة ووقود. عادة ما يكون المنتج المتشكل في تفاعل الاحتراق هو الوقود المؤكسد (والذي يتم تحريره في الغالب في الحالة الغازية). غالبًا ما يشار إلى هذا باسم الدخان. ليس من غير المألوف أن تصاحب تفاعلات الاحتراق ألسنة اللهب. ومع ذلك ، من الضروري ملاحظة أنه لا تؤدي جميع تفاعلات الاحتراق إلى نشوب حرائق.
تعريف تفاعلات الاحتراق
تشير تفاعلات الاحتراق إلى تفاعل كيميائي طارد للحرارة بدرجة حرارة عالية. يحدث بين الوقود (المختزل) والمؤكسد ، وهو عادة الأكسجين الجوي الذي ينتج منتجات مؤكسدة وغازية في كثير من الأحيان ، مما يؤدي إلى مزيج من الدخان.
تنتج عن تفاعلات الاحتراق في النار لهبًا ، وبالتالي يمكن للحرارة المنبعثة أن تجعل الاحتراق مستدامًا ذاتيًا. غالبًا ما تكون تفاعلات الاحتراق عبارة عن سلسلة معقدة من التفاعلات الجذرية الأولية.
مفهوم تفاعل الاحتراق
الخشب والفحم ، إلخ ، كل هذا الوقود الصلب يخضع أولاً لانحلال حراري ماص للحرارة لإنتاج وقود غازي ، ثم يؤدي احتراقه إلى توفير الحرارة اللازمة لإنتاج المزيد منها.
دائمًا ما يكون تفاعل الاحتراق لوقود عضوي في الهواء طاردًا للحرارة لأن الرابطة المزدوجة في O2 أضعف بكثير من الروابط المزدوجة الأخرى أو أزواج الروابط المفردة ، وبالتالي يؤدي تكوين روابط أقوى في منتجات الاحتراق CO2 و H2O إلى إطلاق من الطاقة.
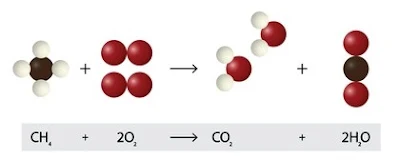
المعادلة الكيميائية للاحتراق
عادة ما ينبعث من التفاعل الحرارة والأضواء. المعادلة المعتادة لتفاعل الاحتراق الكامل هي
CH4 + O2 → CO2 + H2O
أمثلة على تفاعلات الاحتراق
حرق أي نوع من الخشب أو الفحم لتدفئة منزلك.
السيارات والحافلات تحرق البنزين أو الديزل للتشغيل.
يتم استخدام الغاز الطبيعي أو غاز البترول المسال على موقد الطهي الخاص بك. يساعد احتراق هذه الغازات في الطهي.
لإنتاج الطاقة في محطات الطاقة الحرارية.
احتراق البيوتان (يوجد عادة في الولاعات).
تفاعل الاحتراق بين الهيدروجين والأكسجين لتوليد طاقة نظيفة في سفن الصواريخ.
في تفاعلات الأكسدة والاختزال هذه ، يتم دمج أيونات معينة في الوقود لإضفاء لون على اللهب في الألعاب النارية
أنواع تفاعلات الاحتراق
1. تفاعل احتراق كامل
في هذه العملية ، يحترق المتفاعل في الأكسجين وينتج عددًا محدودًا من المنتجات. عندما يحترق الهيدروكربون في وجود الأكسجين ، فإن التفاعل ينتج عنه في المقام الأول ثاني أكسيد الكربون والماء. عندما تحترق العناصر ، تكون المنتجات هي الأكاسيد الأكثر شيوعًا.
2. تفاعل الاحتراق غير تام
يحدث هذا النوع من التفاعل عندما يكون هناك نقص في الأكسجين للسماح للوقود بالتفاعل تمامًا لإنتاج ثاني أكسيد الكربون والماء. يحدث أيضًا عندما يتم إخماد الاحتراق بواسطة المشتت الحراري ، مثل السطح الصلب أو مصيدة اللهب.
يتم إنتاج الكربون وأول أكسيد الكربون و / أو الهيدروكسيد بدلاً من ثاني أكسيد الكربون. يسبب أول أكسيد الكربون الصداع والدوخة والقيء والغثيان. كما أنها ضارة جدًا ببيئتنا.
3. تفاعل مشتعل
إنه نوع من تفاعل الاحتراق الذي غالبًا ما يكون بطيئًا. كما أن لديها درجة حرارة منخفضة ، وعديمة اللهب ، وتتحملها الحرارة المتصاعدة عندما يهاجم الأكسجين مباشرة سطح وقود المرحلة المكثفة. وهو عادة تفاعل احتراق غير كامل.
مثال ، بدء حرائق سكنية على أثاث منجد بمصادر حرارة ضعيفة (على سبيل المثال ، سيجارة ، سلك قصير الدائرة).
4. تفاعل تلقائي
إنه نوع من الاحتراق يحدث بالتسخين الذاتي ، يليه الهروب الحراري وأخيراً الاشتعال. على سبيل المثال ، يحترق الفسفور في درجة حرارة الغرفة دون استخدام الحرارة.
5. تفاعل سريع
كما يوحي الاسم ، فهو تفاعل احتراق سريع ، مع إطلاق كميات كبيرة من الحرارة والطاقة الضوئية ، مما يؤدي غالبًا إلى حدوث لهب. على سبيل المثال ، النار التي تطلق كلا من الحرارة والضوء.
6. تفاعل مضطرب
هذا النوع من الاحتراق الذي ينتج عنه لهب مضطرب هو الأكثر استخدامًا في التطبيقات الصناعية.
7. تفاعل الاحتراق الدقيق
الاحتراق الذي يحدث بأحجام صغيرة جدًا هو الاحتراق الصغير.
المعادلات الكيميائية لتفاعلات الاحتراق الهامة
بعض تفاعلات الاحتراق الهامة ومعادلاتها الكيميائية مذكورة أدناه.
يتضمن احتراق الميثانول (يشار إليه أحيانًا باسم "كحول الخشب") تفاعلًا كيميائيًا بين الميثانول والأكسجين. يتم إعطاء المعادلة الكيميائية لهذا التفاعل من خلال:
2CH3OH + 3O2 → 4H2O + 2CO2
من المعروف أيضًا أن تفاعلات الاحتراق التي يتعرض لها الميثان تنتج الماء وثاني أكسيد الكربون كمنتجات. يمكن تمثيل هذا التفاعل بالمعادلة الكيميائية التالية:
CH4 + 2O2 → 2H2O + CO2
يتم تمثيل احتراق البروبان ، الذي يستخدم على نطاق واسع في تجهيزات الطهي مثل مشاوي النار ، بالمعادلة الكيميائية التالية:
2C3H8 + 7O2 → 8H2O + 6CO2
تفاعل احتراق مهم آخر يتضمن أكسدة الهيدروكربون هو احتراق الإيثان. فيما يلي المعادلة الكيميائية للتفاعل بين الإيثان والأكسجين الذي ينتج عنه ثاني أكسيد الكربون والماء.
2C2H6 + 7O2 → 6H2O + 4CO2
يخضع النفثالين أيضًا للاحتراق في وجود الأكسجين لتوفير غاز ثاني أكسيد الكربون والماء. يتم إعطاء المعادلة الكيميائية لهذا التفاعل من خلال:
12O2 + C10H8 → 4H2O + 10CO2
آلية عمل تفاعلات الاحتراق
تفاعل الاحتراق الكامل الذي يحدث في الأكسجين هو تفاعل متسلسل يشارك فيه العديد من الوسطاء الجذريين المتميزين. يتم تفسير الطاقة العظيمة المطلوبة للبدء من خلال البنية الغير العادية لجزيء الديوكسيجين.
التكوين الأقل طاقة لجزيء الديوكسيجين هو ديراديكال ثابت وغير متفاعل نسبيًا في حالة دوران ثلاثية. عادة ما تكون معظم أنواع الوقود في حالة واحدة ، مع دوران مزدوج وزخم زاوي إجمالي صفري.
لبدء الاحتراق ، فإن الطاقة مطلوبة لإجبار ثنائي الأكسجين على الدخول في حالة اقتران الدوران ، أو الأكسجين المفرد. هذا الوسيط هو رد الفعل للغاية. إنه يمد الطاقة على شكل حرارة ، ومن ثم ينتج التفاعل حرارة إضافية ، مما يسمح لها بالاستمرار.
في حالة الهيدروكربونات ، فإن استخراج ذرة الهيدروجين (وليس تجريد البروتون) يبدأ التفاعل من الوقود إلى الأكسجين ، لإعطاء جذور هيدروكسيد (HOO). يتفاعل HOO بشكل أكبر لإعطاء هيدروكسيدات ، والتي تتفكك لإعطاء جذور الهيدروكسيل.
تحدث تفاعلات الانحلال الحراري في الوقود السائل الصلب والثقيل الذي يعطي وقودًا غازيًا يتأكسد بسهولة أكبر. كل هذه التفاعلات ماصة للحرارة وتتطلب مدخلات طاقة ثابتة من تفاعلات الاحتراق المستمر.
ضع قائمة ببعض الأمثلة الشائعة لتفاعلات الاحتراق.
تفاعل الاحتراق هو نوع من التفاعل الكيميائي يحدث فيه تفاعل بين أي مادة قابلة للاحتراق وعامل مؤكسد من أجل تكوين منتج مؤكسد. غالبًا ما تكون تفاعلات الاحتراق مصحوبة بحرائق وإطلاق للطاقة في شكل حرارة. في معظم تفاعلات الاحتراق ، يتفاعل الهيدروكربون عادةً مع الأكسجين لتكوين ثاني أكسيد الكربون والماء.
أسئلة يتكرر طرحها عن تفاعلات الاحتراق
ما هو تفاعل الاحتراق الكامل؟
تتضمن تفاعلات الاحتراق الكاملة ، التي يشار إليها أحيانًا باسم تفاعلات الاحتراق النظيف ، الأكسدة الكاملة للوقود (عادةً ما يكون هيدروكربونًا). غالبًا ما تحرر مثل هذه التفاعلات الماء وثاني أكسيد الكربون فقط كمنتجات. من الأمثلة الشائعة على تفاعل الاحتراق النظيف الاحتراق الذي يخضع له الشمع. الشمع عبارة عن مادة هيدروكربونية تخضع للاحتراق النظيف لإنتاج ثاني أكسيد الكربون فقط وكميات صغيرة من الماء كمنتج. يمكن أيضًا ملاحظة أنه لا يتم ترك أي رماد / منتجات ثانوية عند احتراق الشمعة بأكملها.
ما هي تفاعلات الاحتراق الغير الكامل؟
تفاعلات الاحتراق غير المكتملة (يشار إليها أحيانًا باسم تفاعلات الاحتراق "القذرة") هي تفاعلات الاحتراق التي تتضمن تكوين منتجات ثانوية مثل الرماد والسخام. ليس من غير المألوف أن تؤدي تفاعلات الاحتراق هذه أيضًا إلى تحرير أول أكسيد الكربون (غاز شديد السمية مع الصيغة الكيميائية CO) كأحد المنتجات. من الأمثلة الشائعة على تفاعل الاحتراق غير الكامل حرق الأخشاب.
كيف تعرف اكتمال تفاعل الاحتراق؟
الإجابة: يتطلب الاحتراق حدوث ثلاثة أشياء: الوقود (الهيدروكربونات) والأكسجين (من الهواء) والشرارة التحفيزية. الاحتراق الكامل عند اكتماله سينتج فقط ثاني أكسيد الكربون والماء كمنتجات ولن يتبقى أي شيء.
ومع ذلك ، فإن الاحتراق غير الكامل ينتج عنه منتجات ثانوية أخرى مثل أول أكسيد الكربون أو السخام الكربوني المتخلف.